���ጦ���ٸ��g�g���F��
2019-4-13 11:54:23 �c����
ijЩ����ٻ���Ͻ������ijЩ���|�h(hu��n)�����l(f��)��һ�NꖘO��������ĬF������늻��W���ܽӽ����F���������ٵ��@�Nʧȥ��ԭ���Ļ��W���ԵĬF�Q���g���������g�������@�õ����g���|�Q���g�����g������˽��ٵĸ��g�ٶȣ������˽��ٵ����g����
���ٵ��g���F������20���o���ͱ��˂��l(f��)�F���������F��ϡ�����и��g�ܿ������ڝ������Єt���g������1836����˹�±ȷQ�����ڝ������Ы@�õ����g��B(t��i)���g�B(t��i)����Ŀǰ��ֹ�˂������ٵ��g�����M���ˏV�����о������ڿ��ƽ��ٸ��g����߽��ٲ��ϵ����g�Է���l(f��)�]��ʮ����Ҫ��������
�D��1���F�������е��ܽ������c����ĝ���Pϵ
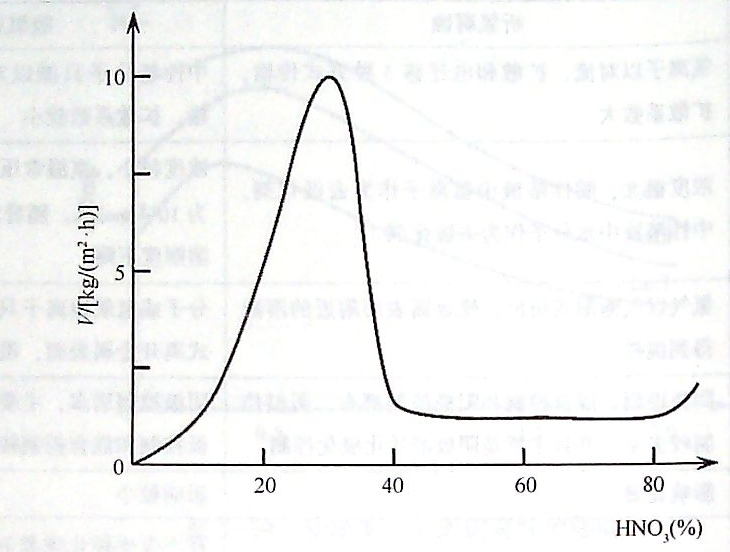
1)���W�g��
���FƬ�������������^���FƬ�ܽ����ʣ����g�ٶȣ��c�����ȵ��Pϵ���õ���D2-21��ʾ��׃���������ĈD�п��Կ��������������^�͕r���F���ܽ������S������ĝ�����Ӷ�Ѹ�������������������ӵ���30%��40%�r���F�ĸ��g�ٶ��_�����ֵ�������ȳ��^40a/o�r���F���ܽ�����Ѹ�ٽ��ͣ�ֱ�������ӽ�ֹͣ���@һ�����F���g��������^�m(x��)������������ʹ�|���֔����^90qo�r�����g�ٶ������^����������@һ�F��Q���^�g�������^������̎�����F�ٷ���ϡ�����������Ҳ�ܱ���һ���ĕr�g�����ܵ����g����ԭ���ǽ��ٱ����ѽ��l(f��)�����g����
���F֮���������������t������@���~���g������u��⁵������m���l����Ҳ���a���g������ʹ�����g�������|�y(t��ng)�Q���g���������������K��Cri0����KMn0����KC10���ȏ��������Լ���Һ�л����е�����ijЩ��������ԇ��Ҳ��ʹijЩ�����g���������V���ښ�������g�����f��≿����}�����g���������y��CI-����������ܰl(f��)���g����

�D��2���������̼䓲��|������Ҫ����g���F��
ֵ��ע��������g���İl(f��)���������ε�ȡ�Q���g�������������ď�����������H��0����KMn0����Һ������߀ԭ�λ��K��Cr.0����Һ�ߣ��Ǹ������������������H���������F���g�����Ås�Ⱥ��߸�����Na��S��0������߀ԭ�λ��������������������ʹ�F�g�����@Ȼ���@�c��x�ӵ����Լ��λ���g���^�̵�Ӱn�����P��
�C�������������c�g�����Ļ��W���ö��a�����g���F��Q�黯�W�g�������g�����������t���X��⁵Ƚ����ڿ՚��кͺܶ�N��������Һ�ж��ױ����g�����ʷQ�����g�����١�
����׃?y��u)��g�B(t��i)�r����늘O�λһ�㳯���ķ����Ƅӡ�������Fe���λ��-0.2-0.2V���g�������ߵ�0.5��1��ov��Cr���λ��-0.6��0.4 V,�g�����0.8~l-0 V�������λ�������g����Ľ���ʧȥԭ�е�ijЩ���ԣ������g������F���~�}�в��܌��~�ÓQ������
- ��һƪ������20MPa�ض�160����20%HCl�}�����4hԇ�Y 2019/4/22
- ��һƪ�����������g��KN17������ĥͿ��Ч���@�� 2016/9/5
